针对医护人员的新冠疫苗安全性问答
Sonali Kochhar, MD1, Eve Dubé, PhD2, Janice Graham, PhD3, Youngmee Jee MD, PhD4, Ziad A. Memish, MD5, Lisa Menning6, Hanna Nohynek, MD, PhD7, Daniel Salmon, PhD8; Karina Top, MD, MS9, Noni E MacDonald, MD10
隶属关系和利益冲突
-
医学博士,美国华盛顿大学全球卫生系临床副教授;全球医疗保健咨询医疗总监
利益冲突--无须声明 -
博士,魁北克国家公共卫生研究所高级研究员;加拿大拉瓦尔大学人类学特邀教授
利益冲突-无须声明 -
博士,加拿大哈利法克斯达尔豪斯大学大学研究教授兼儿科(传染病)和人类学教授
利益冲突--无须声明 -
博士,首尔国立大学GSPA客座教授;韩国基金会健康外交特别代表
利益冲突--无须声明 -
医学博士,沙特阿拉伯利雅得卫生部国王沙特医学城高级研究和创新中心主任,传染病顾问
利益冲突--无须声明 -
世卫组织总部免疫,疫苗和生物制剂司技术官员,日内瓦
利益冲突--无须声明 -
医学博士,芬兰THL芬兰卫生与福利研究院主任医师,副院长
利益冲突--我的研究所THL拥有公私合作政策;但我本人和我的部门均未获得此类私人资金/赠款 -
美国约翰·霍普金斯大学公共卫生学院疫苗安全研究所所长,教授
利益冲突--咨询和/或与Merck,Janssen和Walgreens合作 -
医学博士,理学硕士,加拿大新南威尔士州达尔豪斯大学儿科学与社区卫生与流行病学副教授
利益冲突--在过去的三年中,我收到了辉瑞公司的咨询费,我的机构获得了葛兰素史克公司与本项工作无关的资助 -
医学博士,加拿大IWK健康中心Dalhousie大学儿童医学教授,
利益冲突--无须声明
CONSIDER(新冠疫情疫苗安全问题和健康护理专家)工作组(WG)
考虑到COVID-19疫苗的极端重要性以及了解其安全必要性,于2020年9月成立了CONSIDER(新冠疫情疫苗安全问题和健康护理专家)工作组(WG)。
CONSIDER WG的目的是在推出新冠疫苗期间为疫苗安全性有关的问题提供清晰,全面的答案并且:
1)促进利益相关者之间的科学讨论,包括一线医疗工作者在内的疫苗受种者,以及
2)增加信息的理解和透明度,以促进信息接受。
鉴于疫苗的加速开发、不信任政府疫情应对以及在某些人群中对疫苗犹豫越来越高,新冠疫苗可能引起人们的各种质疑1-4。所有新疫苗,在临床试验中可能未能发现罕见的不良反应,而在大规模人员接种疫苗后方才发现。此外,在大规模人群接种疫苗时,其中一些人在接种疫苗后不久出现偶合的不良健康后果。这些都需要尽快处理好对新冠疫苗的安全性质疑。 CONSIDER小组的成立旨在为关键利益相关方的常见新冠疫苗安全性问题提供可理解和可及的答案。
每个答案均由工作组的专家成员撰写,并由两个或多个其他成员审阅。
科学发展迅速。随着更多的问题引起小组的注意或获得更多的信息(来自COVID-19疫苗的临床试验以及在国家中引入疫苗的早期经验),答案将得到更新并发布新答案。问题和答案托管在此页面(https://canvax.ca/covid-19-vaccine-questions-and-answers-healthcare-providers),并在其他站点上交叉引用。
本页提供的信息是由国际免疫专家组撰写的,适用于全球范围,包括加拿大。
以下是答案的最新版本。添加新答案后,此网页将更新。
参考文献
- Schaffer DeRoo S, Pudalov NJ, Fu LY. Planning for a COVID-19 Vaccination Program. JAMA. 2020; 323(24):2458-2459. doi:10.1001/jama.2020.8711
- Lancet COVID-19 Commissioners, Task Force Chairs, and Commission Secretariat. Lancet COVID-19 Commission Statement on the occasion of the 75th session of the UN General Assembly. Lancet. 2020:S0140-6736(20)31927-9. doi: 10.1016/S0140-6736(20)31927-9.
- Kochhar S, Salmon DA. Planning for COVID-19 vaccines safety surveillance. Vaccine. 2020 Sep 11;38(40):6194-6198. doi: 10.1016/j.vaccine.2020.07.013
- MacDonald NE, Dube E. Vaccine safety concerns: Should we be changing the way we support immunization? EClinicalMedicine. 2020 Jun; 23:100402. doi: 10.1016/j.eclinm.2020.100402.
分享您的问题
COVID-19 疫苗安全性问题解答
临床试验相关
在使用疫苗之前如何确定疫苗的安全性?
Eve Dubé 及答疑团队
与治疗患者的药物不同,用于健康人的疫苗是为了预防疾病。因此,在使用前疫苗通常需要比治疗药物更高的安全性证据。疫苗的开发需经过一系列严格且认真执行的科学和伦理的流程和规程,以确保疫苗在大规模人群使用之前的安全性和有效性(参见加拿大疫苗安全体系的麦克唐纳和法律1,许多其他国家/地区也采用了非常相似的方法)。
首先,在临床前研究中采用组织培养、细胞培养或动物模型(例如,小鼠、雪貂或猴子)评估疫苗的安全性和免疫原性(即,疫苗诱导免疫应答的能力)。如果临床前研究成功(包括安全性和免疫原性),则将开展人体临床试验。在每个阶段,政府监管机构都会对研究和试验的数据进行评估,以准许其进入下一阶段。
期临床试验涉及一小群成年人(通常包括20-100名健康志愿者),旨在评估疫苗的安全性以及免疫应答的类型和程度。如果I期临床试验没有发现问题,则试验疫苗将推进至纳入数百名个体的II期临床试验。II期临床试验的目的是评估疫苗的安全性、免疫原性、剂量和免疫程序。如果II期临床试验成功,将对成千上万的人开展更大规模的III期临床试验,以评估试验疫苗的效力并进一步研究安全性。上述是随机双盲试验,将候选疫苗与对照疫苗或安慰剂(通常是非活性物质,例如,生理盐水注射液)进行比较。III期临床试验可用于识别罕见的不良反应,这些不良反应因发生率太低而很难在I期或II期临床试验中发现(例如,发生率小于1~10/10,000)。2
然后,由政府监管机构的审评员(独立于研究人员)评估上述试验中获得的疫苗安全性和有效性的信息。通常,非政府专家也会审核数据。在仔细审核数据并获得监管机构的批准后,可以在该国使用该疫苗。疫苗获得批准后,其安全性仍将继续通过主动和被动的监测方式进行评估,以确保识别出与疫苗相关的非常罕见的不良反应的可能风险(参见最后一个问题”疫苗的长期影响”)。
即便新冠疫苗的开发加速,其开发依旧适用上述标准(参见问题4)。3 许多新冠疫苗采用过去已被其他疫苗和药物证明安全的方法和技术进行开发,有些则使用了新技术。与所有新疫苗一样,疫苗的安全性是非常令人关注和重视的问题。
参考文献
-
MacDonald NE, Law BJ. Canada’s eight-component vaccine safety system: A primer for health care workers. Paediatrics & Child Health, 2017, e13-16 Online: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5825834/pdf/pxx073.pdf Page Accessed September 28, 2020
-
Vaccine Testing and Approval Process. Centers for Disease Control and Prevention. Online: https://www.cdc.gov/vaccines/basics/test-approve.html Page Accessed on September 25, 2020
-
Accelerating a safe and effective COVID-19 vaccine. World Health Organization. Online: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/accelerating-a-safe-and-effective-covid-19-vaccine Page Accessed on September 25, 2020
哪些措施可以确保疫苗安全?
Janice Graham 及答疑团队
众多审查(法律、法规和指南)有助于确保国家监管机构(NRAs)批准的疫苗安全有效,NRAs包括美国食品与药品管理局、加拿大卫生部和欧洲药品管理局(EMA)等。国家监管机构监督临床试验的批准,并在该国批准疫苗、治疗药物或医疗设备之前审慎评估相关证据。研究机构的伦理委员会(IRB或REB)确定临床试验方案是否符合知情同意、决策能力、试验实施、研究参与的公平性和平等性、隐私和保密性、利益冲突、安全性监测和报告,以及注册的伦理标准(例如,加拿大三大研究理事会研究伦理)。国际机构(例如ICHGCP指南)负责监督人体研究以及履行对安全性、效力和质量的监管义务。1
每个临床试验都设有数据和安全监测委员会(DSMB),在试验期间以预定的时间间隔评估中期数据。当发生非预期不良事件时,试验可能会暂停;如果认为不值得继续试验,则可完全终止。世界卫生组织(WHO)协调专家咨询小组,审议全球卫生事务,提供伦理指导,并与国家监管机构合作在低收入国家许可使用安全疫苗。WHO鼓励各国设立独立的国家免疫技术咨询小组(NITAG),基于当地流行病学审核获批疫苗的数据,以确定谁应接种该疫苗(如果有)。国家免疫技术咨询小组应建设全球疫苗安全标准的能力。2,3
疫苗批准前整个生命周期的透明度对于安全性和公众信任至关重要,包括审核所有试验方案、所有数据和技术文件、临床研究报告、停止规则和决策过程。4,5在公共卫生应急情况下对紧急研究的特殊需求可以指导伦理审查,并为国家监管机构创建任务授权,以加快临床试验的监管途径,并考虑附条件批准和/或颁发紧急使用授权。尽管存在政治压力,加拿大、美国和欧洲的国家监管机构拒绝采取捷径。对更快的批准应保持警惕,以确保安全性不打折扣。6,7,8
限制利益冲突、提高生产质量及报告严重的预防接种后不良事件(AEFIs)的法律和法规标准可确保疫苗安全。为了使人们相信快速开发的新冠疫苗将是安全的,公众需要确保:
- 明确的披露准则,将有利益冲突(个人和专业)者排除在决策之外;
- 透明和开放获取所有试验方案、数据(包括疫苗成分,如佐剂)、修订和调整,以及决策过程和基本原理;
- 对压缩测试阶段的适应性试验进行修改或因响应新发现而增加新组别,不会增加参与者的风险。如果,正如GAVI所述“这些改变不是凭空猜测-而是基于科学家(评估不确定性的专家)已明确定义的规则”。9 这些修改应立即公告,即透明,并有理由和数据/证据支持那些决策;
- 对所有临床试验证据和决策依据、咨询委员会的建议及疫苗的推广进行独立评估,以解决对利益冲突的看法;
- 需要具有足够把握度的临床试验,以确保安全性和有效性。如果试验参与者人数较少,III期临床试验可能会漏检罕见(发生率≥0.01%且<0.1%)但严重的不良事件。大样本量试验人群对于识别导致发病的罕见和非常罕见的严重不良事件很重要(例如,Rotashield导致肠套叠);
- 上市后安全监测和主动监测必须落实到位,以检出接种后非常罕见的严重不良事件和免疫失败;
- 预防疾病而非替代终点(例如,血清学)是更高的标准;
- 在疾病流行地区开展III期临床试验对于疾病暴露和确定疾病预防至关重要;
- 由于尚无治愈新冠肺炎的方法,因此,现阶段开展人类挑战试验存在伦理问题;
- 公平参与有严重疾病风险的代表性不足的社区的研究,例如,老年人、不同种族/民族群体、孕妇和免疫力低下者。
参考文献
- Dixon, J.R. The International Conference on Harmonization Good Clinical Practice guideline. Quality Assurance 1998; 6(2):65-74. doi: 10.1080/105294199277860.
- Graham, J.E, Borda-Rodrigeuz, A., Huzair, F., & Zinck, E. Capacity for a global vaccine safety system: The perspective of national regulatory authorities. Vaccine, 2012; 30(33), 4953-4959. doi:10.1016/j.vaccine.2012 .05.045.
- Harmon, S.H.E., Faour, D.E., MacDonald, N.E., Graham, J.E., Steffen C., Henaff L, Shendale S., the Global NITAG Network Survey Correspondents. Immunization governance: Mandatory immunization in 28 Global NITAG Network countries. Vaccine https://doi.org/10.1016/j.vaccine.2020.09.053
- Morten C.J., Kapczynski A, Krumholz HM, Ross, J.S. To help develop the safest, most effective coronavirus tests, treatments, and vaccines, ensure public access to clinical research data. Health Affairs Blog, March 26, 2020. https://www.healthaffairs.org/do/10.1377/hblog20200326.869114/full/
- Herder, Matthew and Janice E. Graham. Opinion: Herder and Graham: Canadians need and deserve transparency on COVID-19 vaccines. Ottawa Citizen Sept 15, 2020. https://ottawacitizen.com/opinion/herder-and-graham-canadians-need-and-deserve-transparency-on-covid-19-vaccines
- Graham, J.E. Smart Regulation: Will the government’s strategy work? Canadian Medical Association Journal 2005;173(12),1469-1470. doi: 10.1503/cmaj.050424. Retrieved from https://www.cmaj.ca/content/173/12/1469.short
- Graham, J.E., & Nuttall, R. Faster Access to New Drugs: Fault Lines Between Health Canada’s Regulatory Intent and Industry Innovation Practices. Ethics in Biology, Engineering & Medicine – An International Journal 2013;4(3),231-239. doi: 10.1615/EthicsBiologyEngMed.2014010771. (http://hdl.handle.net/10222/75934)
- Doshi, P. Pandemrix vaccine: why was the public not told of early warning signs? BMJ 2018;362:k3948 doi: 10.1136/bmj.k3948.
- GAVI. Can vaccine clinical trials be sped up safely for COVID-19? https://www.gavi.org/vaccineswork/how-covid-19-leading-innovation-clinical-trials
为什么牛津疫苗临床试验被暂停,疫苗安全性如何确定?
Hanna Nohynek 及答疑团队
一名受试者在接种疫苗后出现了手臂和腿部无力,初步诊断为横贯性脊髓炎(一种影响脊髓的炎性综合征)。在进一步评估中,已知另一名受试者诊断患有多发性硬化症,也被认为与新冠疫苗无关。1 在有成千上万名参与者的大型试验中,此类暂停并不少见。疾病可能是偶然发生的,但必须经过独立审查以澄清是否与所研究的药物或疫苗有关。在这种情况下,独立专家得出的结论是该疫苗没有造成上述事件,并允许研究继续在英国、南非、巴西、日本和美国进行招募。
参考文献
- AstraZeneca and J&J get go-ahead to resume Covid-19 vaccine trials. Accessed on October 26, 2020 at https://www.ft.com/content/2d2d0e8c-3560-456f-bf3e-59a869e6aa00
疫苗在国家的纳入
高优先级人群中疫苗的获益-风险评估是什么意思?
Sonali Kochhar 和答疑团队
疫苗接种是预防疾病最成功的公共卫生干预措施之一。1疫苗是针对健康的人群,包括年幼的儿童和弱势人群,因此可接受的疫苗风险水平很低。疫苗必须具有非常有利的获益-风险平衡,这是至关重要的;即与任何危害风险相比,疫苗接种的获益必须更显著。这样才能确保做出适当和明达的公共卫生决策。2
获益-风险评估是对所有疫苗和药品在批准前后的审评过程中进行监管决策的基础。2,3 基于科学证据,仅当获益-风险评估显示足够的正获益-风险平衡后,疫苗或药品才会授权使用。3
对于特定人群(例如,儿童、孕妇和免疫力低下者)以及高风险或低风险的人群(例如,生活在疫情爆发地区),疫苗或药物的获益-风险评估可能会有所不同。3
获益-风险评估应考虑多种因素,包括疾病的严重程度、当前可用于该疾病的药物满足人群医疗需求的程度、疫苗在特定人群中预防疾病的保护效果,以及与疾病的风险相比,相同人群接种后不良事件的风险。2 ,3,4
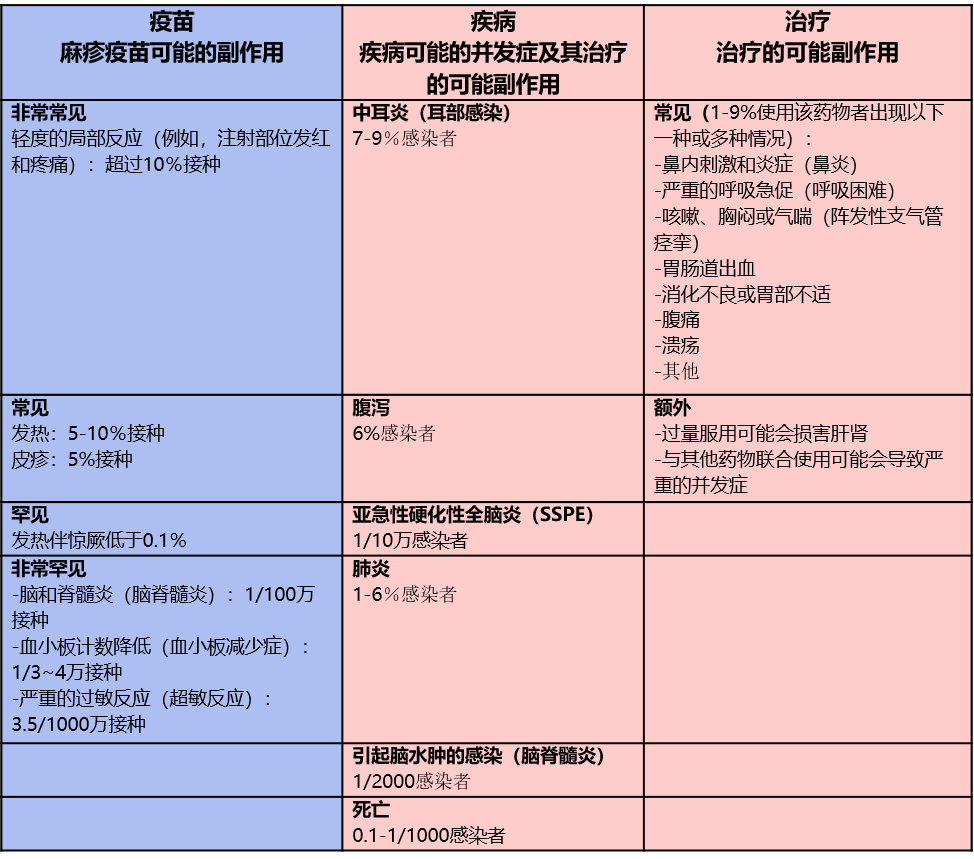
以麻疹疫苗为例,疫苗的获益远大于风险(需要将接种后不良事件的风险与疾病相关的风险进行比较,还应考虑用于缓解疾病症状的治疗的副作用的风险)。5
麻疹疫苗的风险评估5
(接种后不良事件的风险与疾病相关的风险,以及用于缓解疾病症状的治疗的副作用的风险相比)

参考文献
- Rémy V, Zöllner Y, Heckmann U. Vaccination: the cornerstone of an efficient healthcare system. J Mark Access Health Policy. 2015;3:10.3402/jmahp.v3.27041. doi:10.3402/jmahp.v3.27041
- Arlegui, H., Bollaerts, K., Salvo, F. et al. Benefit–Risk Assessment of Vaccines. Part I: A Systematic Review to Identify and Describe Studies About Quantitative Benefit–Risk Models Applied to Vaccines. Drug Saf (2020). https://doi.org/10.1007/s40264-020-00984-7
- Benefit-risk assessment in drug regulatory decision-making. Draft PDUFA VI Implementation Plan (FY 2018-2022). FDA. March 30, 2018. Accessed on Sept 30, 2020 at https://www.fda.gov/media/112570/download
- Curtin F, Schulz P. Assessing the benefit: risk ratio of a drug--randomized and naturalistic evidence. Dialogues Clin Neurosci. 2011;13(2):183-90. PMID: 21842615; PMCID: PMC3181998.
- Risk scales : benefits of vaccines far outweigh the risks. WHO Europe. Accessed on Oct 9, 2020 at https://www.euro.who.int/en/health-topics/disease-prevention/vaccines-and-immunization/publications/2017/risk-scales-benefits-of-vaccines-far-outweigh-the-risks-2017
疫苗接种有哪些常见的副作用?
Youngmee Jee 和答疑团队
与疫苗有关的副作用是指由研究显示因疫苗引起的任何健康问题。另一方面,不良事件是指疫苗接种后发生的任何健康问题,这些问题可能是偶然的,也可能与疫苗有关。
我们尚无足够的临床试验数据来说明新的新冠疫苗会导致的轻度和严重不良事件。但是,我们确实知道其他类型的注射疫苗所引起的不良事件。
- 轻度的常见副作用包括:注射部位疼痛、注射部位发红/肿胀、低热、疲劳、头痛以及轻度的肌肉和/或关节痛(参见表1)。1通常,上述轻度的副作用会在注射后几个小时内发生,但几天后就会消退。
- 严重的副作用,例如,癫痫发作、血小板减少症和持续哭闹较少发生,且通常不会导致长期问题。1
- 过敏反应(例如,超敏反应)非常罕见,但可以在接种后立即(通常在几分钟内)发生(例如,由于新霉素等疫苗成分所致),并且可能危及生命。医疗保健人员应提前做好治疗超敏反应症状的准备。1
- 疫苗不良事件可分为5类:
- 疫苗产品-相关反应;
- 疫苗质量检测-相关反应;
- 接种错误-相关反应;
- 免疫应激-相关反应;和
- 偶合事件。1
- 如果导致死亡、危及生命、需要住院或延长现有住院时间、永久或严重的残疾/功能丧失、先天性异常/出生缺陷,或需要干预以预防损害,则AEFI将视为严重不良事件。一些儿童疫苗AEFI的预期发生率参见https://vaccine-safety-training.org/。1
- 辉瑞新冠疫苗III期临床试验的安全性数据显示,2 老年人群中常见的副作用(如头痛、寒战、关节痛和腹泻)的发生率低于年轻年龄组。第二剂接种后大多数副作用为轻度至中度。监管机构在决定是否批准使用疫苗时将审慎评估所有数据。
- Moderna新冠疫苗已报导的安全性资料3也显示发生轻度的常见副作用。 值得注意的是,全身性不良事件在第二剂接种后和最高剂量组中更为常见。
- 新冠疫苗III期临床试验已接种超过20,000名受试者,很少或没有发生严重不良事件,且显示出有效性,很可能将获得监管部门的批准使用。4
表1. 常见、轻度的疫苗反应和治疗
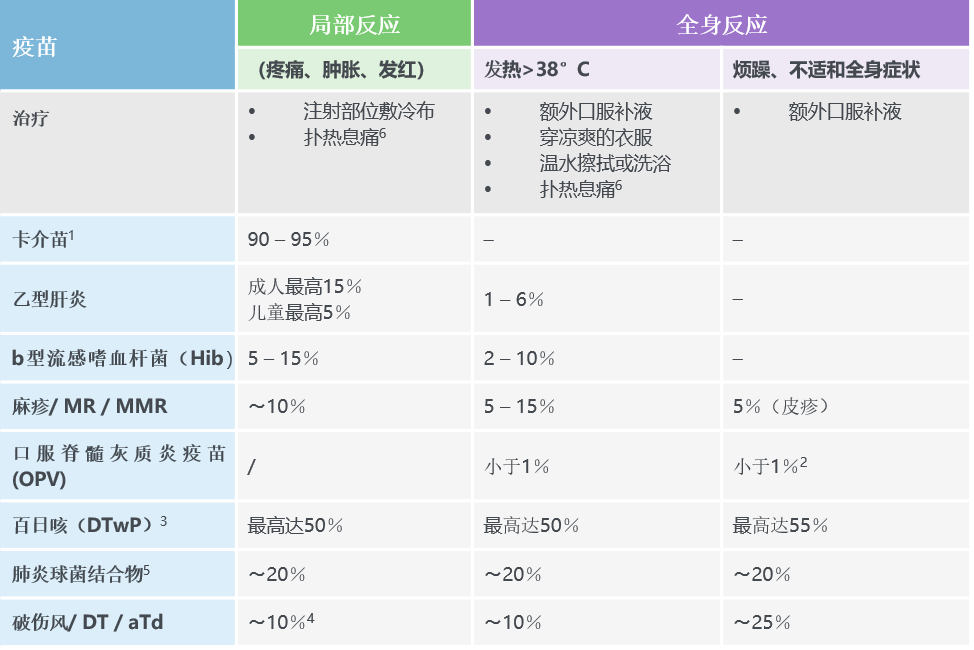
2. 腹泻、头痛和/或肌肉疼痛。
3. 与全细胞百日咳(DTwP)疫苗相比,无细胞百日咳(DTaP)疫苗的发生率较低。
4. 局部反应的发生率可能会随着加强剂次而增加,最高可达50 – 85%。
5. 资料来源:http//www.cdc.gov/vaccines/hcp/acip-recs/
6. 扑热息痛的剂量:每6-8小时最高15mg / kg,24小时内最多4剂。
资料来源:WHO疫苗安全基础电子学习课程(模块3:预防接种后不良事件)
参考文献
-
WHO vaccine safety basics e-learning course. Accessed on 18 Oct 2020 at https://vaccine-safety-training.org/
-
Pfizer says Covid-19 vaccine showed moderate side effects. Accessed on
https://www.clinicaltrialsarena.com/news/pfizer-covid-vaccine-tolerability-data/ -
Anderson EJ, Rouphael NG, Widge AT, Jackson LA, Roberts PC et al. Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults. N Engl J Med. 2020 Sep 29. doi: 10.1056/NEJMoa2028436.
-
Grech V, Calleja N. Theoretical novel COVID-19 vaccination risk of rare and severe adverse events versus COVID-19 mortality. Early Hum Dev. 2020 Oct 1:105212. doi: 10.1016/j.earlhumdev.2020.105212.
如果疫苗接种者出现副作用,将采取哪些措施?
Noni MacDonald 和答疑团队
副作用称为不良事件 - 那些接种后发生的称为预防接种后不良事件(AEFI)。
“接种后出现的任何不良的医学事件,不一定必须与疫苗的使用存在因果关系。不良事件可能是任何不利或非预期的体征、异常实验室发现、症状或疾病。” 1
根据不同免疫类型,常见、轻度的AEFI包括体征和症状,例如低热、肌肉疼痛、身体疼痛、局部疼痛、注射部位发红和/或肿胀,通常在不到20%的接种者中发生,出现在注射后数小时内,可以在短时间内康复,且不会产生长期后果。对于任何新疫苗(例如新冠疫苗),都应谨慎确定轻度AEFIs的发生率是否与临床试验所述相似,以及这些轻度AEFI在不同年龄组或具有不同基础疾病的人群中是否更常见,即临床试验中可能未获得的信息。
AEFI的程度通常是轻度的,很少发生中度或重度(例如,轻度或中度发热)。重度AEFI不一定会导致长期问题。1
迅速引起关注的AEFI是“严重”AEFI。
“严重AEFI会导致死亡、危及生命、需要住院治疗或延长现有住院时间、导致永久或严重的残疾/功能丧失、先天性异常/出生缺陷,或需要干预以防止永久性损害。” 1
因为非常罕见(发生率低于1/10000),严重AEFI通常不会在临床试验中检出。严重AEFI的关键点是确定其是否归因于疫苗本身(疫苗产品-相关反应);是否为疫苗质量缺陷相关反应(疫苗的生产问题);是否为程序错误,接种错误-相关反应(例如,疫苗储存不当、使用的稀释剂错误等);是否为免疫应激-相关反应(偶合事件)。1,2
事件通常是偶合的。需注意,如果严重AEFI确实与疫苗有关,则可能会采取纠正措施,比如召回疫苗。然而,由于接种前严谨的审批流程、严格的批准流程以及高质量的生产过程,因疫苗本身的问题导致的严重AEFI很少见。
卫生保健工作者在AEFI相关方面有多个非常重要的作用。
a)识别并报告严重AEFI,和轻度AEFI(如果必要);
b)为AEFI患者提供护理;
c)帮助收集因果关系评估委员会确定严重AEFI与疫苗相关或不相关所需的病例信息;3
d)在作出导致AEFI的原因的任何结论时保持客观;
e)基于事件的已知事实,以有效、及时和尊重的方式进行沟通。还应准备与当地公共卫生机构就事件和采取的措施进行沟通,以调查和确定因果关系。3 ,4与他们和您的机构合作,确保提供准确的信息。请务必验证信息,不要留存任何错误信息。
参考文献
-
World Health Organization. Vaccine Safety Basics e-learning course. Module 3. Adverse events following immunization. https://vaccine-safety-training.org/vaccine-reactions.html. Accessed Sept 24,2020
-
Gold MS, MacDonald NE, McMurtry CM, Balakrishnan MR, Heininger U, Menning L, Benes O, Pless R, Zuber PLF. Immunization stress-related response - Redefining immunization anxiety-related reaction as an adverse event following immunization. Vaccine. 2020; 38(14):3015-3020.
-
World Health Organization. Vaccine Safety Basics e learning course. Module 4: Surveillance. Causality Assessment of AEFIs. https://vaccine-safety-training.org/causality-assessment-of-aefis.html. Assessed Sept 24, 2020
-
World Health Organization EUROPE. Crisis Communication Template (2017). https://www.euro.who.int/en/health-topics/disease-prevention/vaccines-and-immunization/publications/2017/crisis-communications-plan-template-2017. Accessed Sept 24, 2020
疫苗的长期影响
我们如何知道疫苗是否存在长期安全隐患
Karina Top 和答疑团队
引入疫苗后,将对所有由国家监管机构(NRAs)批准使用的疫苗(例如美国食品药品管理局(FDA)或加拿大卫生部)进行安全性和保护效果监测。最低要求是建议各国实施被动监测系统,收集来自医疗保健提供者、疫苗生产企业和公众(经常)的AEFI个例报告。1 对这些报告进行整理和分析,以识别可能表明疫苗有安全隐患的任何模式(例如,特定疫苗接种后某种疾病的报告频率高于基于人群所预期的本底发生率)。建议有能力的国家建立主动监测系统,在接种后识别特别关注的不良事件(例如,癫痫发作、格林-巴利综合症),并比较接种疫苗和未接种疫苗的人群中这些疾病的发生率,以确定不良事件是否系偶合发生(很常见)或与疫苗有关。
与任何新疫苗一样,将加强被动和主动监测系统,以便及时识别出新冠疫苗接种后特别重要的特定不良事件。国家和国际公共卫生组织正在努力制定指南和策略,以确保对新冠疫苗开展可靠的上市后安全性监测。WHO全球疫苗安全咨询委员会和布莱顿协作组(国际疫苗安全专家联盟)与流行病防范创新联盟(CEPI)合作,正在制定指南和病例定义,以监测新冠疫苗的安全性(预计将于2020年12月在线提供)。2
参考文献
-
Department of Immunization, Vaccines and Biologicals. 2012. Global Vaccine Safety Blueprint. Geneva: World Health Organization. Access at: https://www.who.int/vaccine_safety/publications/en/. Accessed: 5 October 2020.
-
2020. Global Advisory Committee on Vaccine Safety, 27-28 May 2020. Wkly Epidemiol Rec. 95:325-336. Access at: https://apps.who.int/iris/bitstream/handle/10665/333136/WER9528-eng-fre.pdf?ua=1. Accessed: 5 October 2020.
分享您的问题
如果您对我们的专家团队有疑问,请联系我们,我们将对其进行审核,以将其纳入问题列表。
